De aarde heeft grote C-reservoirs. 7-8-2020
Grenzen aan de CO2-groei
Een bijdrage van Kees le Pair.
De mythe fossiel CO2 vernietigt de wereld leidt tot zo’n fanatieke CO2-jacht, dat het uitademen in gevaar komt. Tijd dus voor wat verdieping in het goedje zelf(1).
Koolstof
Koolstof, afgekort “C”, is voor het leven een onontbeerlijk element. Samen met zuurstof “O” en waterstof “H” in allerlei verbindingen is C voornaamste bestanddeel van planten, dieren en mensen.
De aarde heeft grote C-reservoirs. Ik noem er enkele. Een volledige lijst – als we die al zouden kunnen maken – zou vele bladzijden beslaan. Steenkool, aardolie, palmolie, olijfolie, aardgas, aardappelen, tarwe, rijst, koeien, walvissen enz. zijn wat bekende uit onze omgeving. Minder bekend, maar enorm als C-reservoir, zijn bergketens, koraaleilanden en schelpen.
Ook de lucht om ons heen bevat koolstof, in de vorm van koolzuurgas. De officiële naam is kooldioxide, CO2; wegens type-gemak tegenwoordig meestal geschreven als CO2. Dat doe ik verder in dit stuk dus ook maar. Onze lucht is een mengsel van gassen. Eén daar van is CO2. Op elk miljoen deeltjes lucht tellen we momenteel (2020) 415 deeltjes CO2 (0,0415% of 415 ppM). Hoewel dat weinig lijkt, is het toch een flinke hoeveelheid. Per slot is er boven elke vierkante centimeter van het aardoppervlak een kilo lucht. En het aardoppervlak telt heel wat vierkante centimeters. Het aardige van de lucht als reservoir is, dat die dankzij de winden goed mengt. Wanneer je ergens wat CO2 in de lucht stopt, is dat in enkele weken over alle lucht in de wereld verspreid. Dat maakt dat de atmosfeer het enige grote koolstofreservoir is, waarvan we vrij nauwkeurig meten, hoeveel koolstof die bevat. Van steenkool of olie, moet je eerst ontdekken waar het zit en dan ook nog hoeveel op die plek. Ook van reservoirs als gebergten is de C-berging lang niet zo goed bekend.
Gassen lossen op in vloeistoffen. Dus ook CO2 in zee. Het oplossen houdt op, wanneer ook in het water een bepaalde evenwichtsconcentratie CO2 aanwezig is. Het is afhankelijk van de temperatuur(2). Koud water houdt meer CO2 vast dan warm. Wanneer een glas koud bier is uitgeschuimd, ontsnappen er opnieuw koolzuurgas-belletjes, als je het opwarmt. Dat maakt het moeilijk de C-inhoud van de oceaan te meten. Het zeewater is hier warm daar koud en het stroomt op verschillende diepten met verschillende snelheden. Indien in de Noordzee de concentratie in evenwicht is met het CO2 in de lucht zal het zelfde water op zijn golfstroomtocht naar het Noorden afkoelen en weer CO2 uit de lucht zuigen. Het omgekeerde gebeurt waar het koude water op zijn weg naar het zuiden opwarmt.
De concentratie van CO2 in de lucht is voor het leven op aarde gunstig. Indien die, in plaats van 0,0415%, 5% of meer zou zijn zouden mensen en andere zoogdieren stikken. En bij een concentratie van minder dan 0,015% zouden planten niet meer groeien. Dan was het afgelopen met het leven, zoals wij dat kennen. Aan het eind van de laatste ijstijd was de concentratie in de lucht 0,018%. Kantje boord dus wat ons betreft.
Al die bladzijden C-reservoirs wisselen koolstof uit met aangrenzende reservoirs. Sommige doen dat snel. Mensen en dieren ademen per minuut vele malen meer CO2 uit dan ze inademen. De gezamenlijke insecten brengen jaarlijks 10x zoveel CO2 in de lucht als wij met al onze machines. Planten hebben om CO2 uit de lucht op te nemen en daar steenkool van te maken, miljoenen jaren nodig. En hele bergruggen bestaande uit diverse carbonaten deden er ook eons over om met hun opgezamelde koolstof uit zee op te rijzen. Het zijn processen met verschillende snelheden en tussen verschillende reservoirs. Schelpdieren maken hun schelpen uit koolstof in zee, niet uit de lucht. Rottende planten brengen het CO2 dat ze eerder uit de lucht haalden weer terug in de lucht, waardoor volgroeide bossen ongeveer CO2-neutraal zijn. (Een klein deel blijft achter in de bodem.) Ook de bodem en de rotsen ontgassen CO2. Maar dat bijvoorbeeld de krijtrotsen van de Engelse Zuidkust verdampt zijn, zal de mensheid, niet meer meemaken.
Talloze onderzoekers proberen al die hoeveel heden in C-reservoirs en de processen waarmee die uitwisselen in kaart te brengen. Het is een schier onmogelijke opgave, wanneer je bedenkt, om welke reservoirs en processen het allemaal gaat. En het zal dus nog vele jaren duren voor we een betrouwbaar beeld hebben. Van enkele ervan hebben we echter wel betrouwbare gegevens. We kennen de hoeveelheid koolstof in de atmosfeer als gezegd nauwkeurig en weten ook hoe die jaarlijks verandert. De concentratie in de lucht is nu 415 ppM en die neemt jaarlijks toe met 2,4 ppM. Een ander gegeven, waarover we zekerheid hebben, is de hoeveelheid CO2 die de mensheid door verbranding van kolen, olie en gas en de cementproductie jaarlijks in de lucht brengt. Kolen-, gas- en olieboeren meten nauwkeurig hoeveel van hun productie jaarlijks als CO2 naar de lucht gaat. Dat komt op het moment overeen met iets minder dan 5 ppM. Alle andere processen die jaarlijks CO2 in de lucht brengen of er uit halen samen vormen dus een netto-afvoer van bijna 2,6 ppM.
Toe- en afvoer in de atmosfeer
Die cijfers zijn opmerkelijk. Want uit al die onderzoekingen is gebleken dat er jaarlijks wel 80 à 100 ppM in en uit de atmosfeer gaat. Dat daarvan op dit moment maar ongeveer 2,4 ppM in de atmosfeer achter blijft, is dus echt opvallend. Figuur 1 laat zien wat de voornaamste bronnen jaarlijks in de lucht brengen.
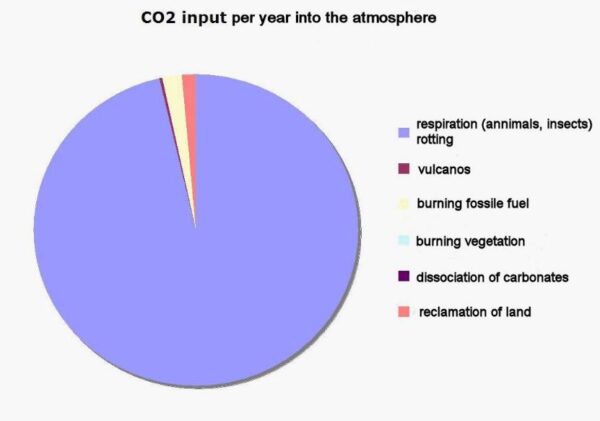 Figuur 1
Figuur 1
De gele sector is het CO2 dat kolen, olie en gas verbruik jaarlijks toevoegen. De andere sectoren zijn minder goed bekend. Van het totaal blijft momenteel 2,4 ppM in de lucht achter. De rest verdwijnt dus weer even snel.
Veel natuurlijke processen verlopen met een snelheid evenredig aan een drijvende kracht. Een aanschouwelijk voorbeeld is een vat met water. Wanneer we de toevoerkraan open zetten vult zich dat, maar als de afvoer onderin een gaatje heeft, loopt het water weg. Hoe hard het wegloopt, hangt af van de waterdruk bij de afvoer. Indien het water twee maal zo hoog staat, zal de afvoer twee maal zo snel gaan. Hoe hoger het water staat, hoe groter die druk. Bij een bepaalde hoogte van het badwater zal de toevoer en de afvoer even groot zijn geworden. Dan gaat er evenveel in als uit en blijft het niveau constant. Zouden we de toevoerkraan verder open draaien, dan gaat het niveau verder stijgen totdat de druk bij de afvoer weer groot genoeg is geworden en we bij een nieuwe waterstand weer evenwicht hebben tussen toe- en afvoer.
Een soortgelijk proces speelt zich ook af bij concentratie verschillen. Denk aan bier, dat in een glas is geschonken. Bij het wegvallen van de overdruk boven de vloeistof ontstaat in enkel seconden de schuimkraag. Maar ook daarna, als de luchtdruk al lang vereffend is, zien we belletjes CO2 uit de vloeistof ontstaan, opstijgen en ontsnappen. Dat gaat een tijd door met geleidelijk minder belletjes per seconde. Na een paar minuten houdt het op. Dan is de concentratie van CO2 in de vloeistof ‘de evenwichtsconcentratie’ die past bij de concentratie van CO2 in de lucht. De snelheid van ontsnapping is dan gelijk aan de snelheid van oplossen van atmosferisch CO2 in het bier. Netjes gemeten verloopt het proces met een snelheid evenredig aan het verschil in concentratie tussen die op elk moment in het bier en de evenwichtsconcentratie die behoort bij de atmosferische CO2 concentratie.
Tijdens de afgelopen 140 jaar hebben wij onafgebroken van fossiele grondstof afkomstig CO2 in de lucht gestopt. In diezelfde periode deden andere bronnen dat ook en hebben diverse reservoirs er CO2 uit opgenomen. Omdat we pas 60 jaar gegevens van betrouwbare directe metingen hebben, toont Figuur 2 hoe dat in die periode met het atmosferisch CO2 ging.
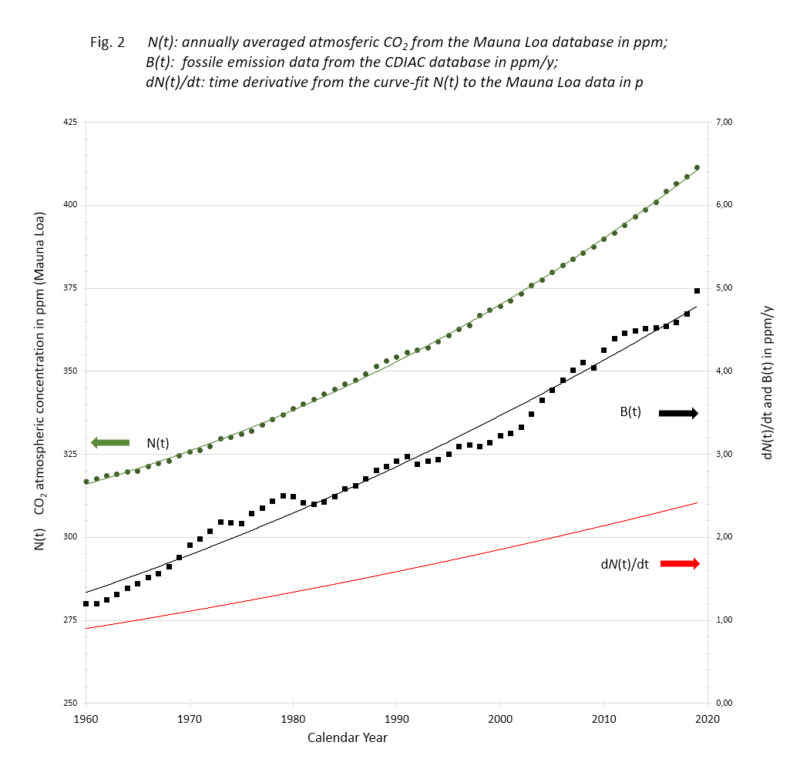
Figuur 2
De groene data zijn de op Mauna Loa, een eiland in de Grote Oceaan, gemeten hoeveelheden CO2 in ppM (linker schaal).
De zwarte wat er jaarlijks aan fossiel CO2 werd ingestopt (rechter schaal).
De rode de jaarlijkse gemeten toename (rechter schaal).
Velen hebben zich afgevraagd hoe lang het extra CO2 in de lucht blijft, voor planten, de oceaan, de grond enz. enz. het hebben opgenomen. De verdwijnsnelheid dus. De uitkomsten van hun onderzoek verschillen nogal. Een greep uit al dat werk is te zien in figuur 3. Daarvan is geen brood te bakken.

Figuur 3.
Al helemaal niet, wanneer je afgaat op de aanname van het IPCC, dat met 100+ jaar rekent (de rode lijn). Nu weten we dat op Climategate het IPCC niet als betrouwbare bron geldt, maar ook zonder het IPCC passen de getoonde procestijden niet goed bij de in Figuur 2 getoonde meetresultaten.
Een stoorzender voor een goed begrip waren metingen aan gemerkt CO2. Atoombomproeven brachten een isotoop van koolstof in de atmosfeer, 14C. Dat verdween snel, wat tot publicaties over korte ontsnaptijden leidde. Dat kwam door een denkfout. Om dat uit te leggen gaan we even terug naar de proef hierboven met het vat water.
Neem aan dat de toevoer kraan één liter water per uur in het vat laat stromen en het water zo hoog staat, dat de afvoer ook één liter per uur doorlaat. Wanneer het vat 1000 liter bevat blijft dat zo, hoe lang je ook wacht, ook al wordt het water geleidelijk ververst. Theoretisch duurt het een eeuwigheid voor alle moleculen die er eerder waren zijn verdwenen. (We ademen dagelijks ook nog wel een paar moleculen CO2 in, die vroeger door Julius Cesar zijn uitgeademd.) Nu veranderen we de proef. We zetten naast het vat een ander vat met 1000 liter rood gekleurd water. En we scheppen met een emmer 20 liter water per uur uit dat vat in het eerste vat en ook 20 liter water uit het eerste terug in het tweede. Binnen enkele dagen zien we dat het water in beide vaten even rood is. De verversing is nagenoeg compleet. Toch is de waterhoogte in ons eerst vat niet verandert. Verversing gaat dus veel sneller, terwijl er aan de hoeveelheden niets verandert.
Zo ging het ook met dat gemerkte koolstof. Door de 20 maal grotere jaarlijkse in en uitstroom van CO2 in de lucht van figuur 1 door snelle in en uitstroom processen, die elkaar netto in evenwicht hielden, verdween het gemerkte CO2 vlug in planten, oceaan enz., die er even snel weer (meest ander) CO2 in terug stopten. Aan het ‘normale’ in- en uitstroom proces veranderde er niets. Dat volgde zijn eigen proces met de daarbij behorende processnelheid.
Terug naar het atmosferisch CO2 dat minder snel toeneemt, dan met wat wij er fossiel instoppen. Uit de metingen volgt nu dat in die 60 jaar – eigenlijk 140 jaar, al zijn de data in oudere jaren minder zeker – de evenwichtsconcentratie in de atmosfeer 287 ppM was(3). En dat de karakteristiek verblijftijd van het meerdere 53,5 jaar was. Karakteristieke verblijftijd is wat minder aanschouwelijk dan “halfwaarde tijd”. Die is dan ~37 jaar. Dat is de tijd die het duurt voor de excesconcentratie ( nu 415 – 295 = 120 ppM ) tot 60 ppM gedaald zou zijn, wanneer wij zouden stoppen met verbruik van fossiele koolstof. In dat geval zou men op Mauna Loa over 37 jaar 355 ppM meten. De aarde moet zich dan verder wel blijven gedragen zoals zij dat de afgelopen 140 jaar heeft gedaan ☺.
De uit de Mauna Loa en fossiel brandstof verbruik data afgeleide afvoer-procestijd is een combinatie van, verschillende, tijden. Afvoeren en toevoeren, die met snelheden evenredig aan concentratie verschil met evenwichtsconcentratie verlopen, zijn er in begrepen.
Nauwkeurigheid
De berekening van de atmosferische CO2 concentratie wijkt over het traject 1960 – heden minder dan 1 ppM af van de op Mauna Loa elk jaar opgegeven waarde. Alleen in de jaren 1993, 1994 & 1997 was het verschil 1,5 ppM. (Een hard spugende vulkaan? Een meer dan normale bosbrand?) Voor een berekening over 140 jaar met die precisie, moet rekening worden gehouden met de geleidelijke verhoging van de evenwichtsconcentratie van 280 tot 295, te wijten aan de temperatuurverhoging.
Toekomst scenarios
In Figuur 4 zijn enkele toekomst scenario’s in beeld gebracht die uit de analyse volgen. Gekozen is voor de volgende vier:
- 1,5% per jaar groeiend fossiel koolstof verbruik zoals dat de afgelopen decennia het geval was.
- Stabilisatie van het fossiel koolstofverbruik op het huidige (2019/2020) niveau, 5 ppM/jaar CO2 naar de atmosfeer. In dat geval zal men op Mauna Loa niet meer meten dan 555 ppM. Verdubbeling van atmosferisch CO2 vanaf de evenwichtsconcentratie (287 ppM) is dan uitgesloten; laat staan vanaf nu (415 ppM).
- Fossiel koolstofverbruik neemt af met 1,5% per jaar. In dat geval is in het jaar 2050 de maximale atmosferische concentratie bereikt. Die is dan 245 ppM. Nadien neemt hij af.
- Wij stoppen in 2020 helemaal met verbruik van fossiele koolstof. In dat geval bevat de atmosfeer in 2080 net iets minder dan 330 ppM.
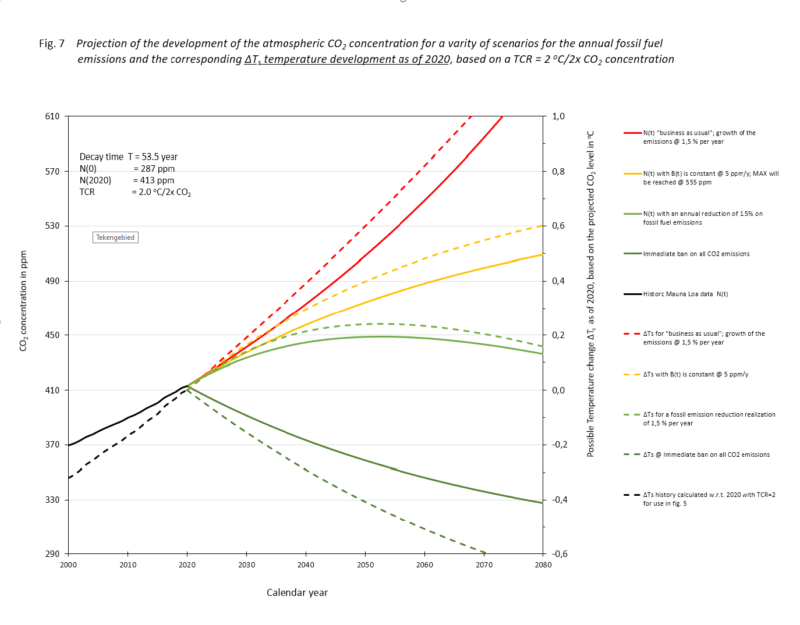
Figuur 4.
De 4 scenario’s in de figuur zijn in de tekst beschreven, (getrokken lijnen, linker schaal, atmosferisch CO2 ppM).
Het IPCC predikt een evangelie van temperatuurstijging als gevolg van het fossiel brandstof verbruik. Op dit moment acht het een ‘TCR’ van 2 °C/2CO2 het meest waarschijnlijk. Voor de grap is met die TCR het temperatuurverschil met nu in de vier scenario’s aangegeven (streepjeslijnen).
Met de TCR van Witteman(4) zou de temperatuurstijging bij het groeiscenario in dit plaatje in 2070 net boven 0,2 °C uitkomen.
Voor de goede orde, de auteur van dit artikel behoort niet tot de IPCC-‘kerk’.
Noten
- Voor een meer wetenschappelijk artikel van Ad Huijser en Kees le Pair “How does our CO2 escape?”, zie http://www.clepair.net/oceaanCO2-4.html .
- Temperatuur en zoutgehalte bepalen naast de partiële druk van het CO2 boven de vloeistof hoeveel CO2 het water kan vasthouden. Dat is voor de concentraties, die voor onze aardse processen van belang zijn, evenredig met die partiële druk. Bij 830 ppM zou de oceaan twee maal zoveel CO2 kunnen bergen als thans. De afhankelijkheid van temperatuur en zoutgehalte – die is ook van plaats tot plaats anders en de zee stroomt (!) – is gecompliceerder. Het in de oceaan opgeslagen CO2 dat in menselijke tijdmaat met de atmosfeer uitwisselt is ongeveer 50x zoveel als dat in de lucht.
- De meeste klimaatonderzoekers veronderstellen dat rond 1880, voor er noemenswaard fossiel CO2 de atmosfeer in ging, de atmosferische concentratie 280 ppM was. Dat zou dan de concentratie zijn, waarbij de atmosfeer met alle andere bronnen en afvoeren in evenwicht was. De temperatuur verhoging van 1,2 °C sindsdien zou die evenwichtsconcentratie nu tot ongeveer 295 ppM hebben verhoogd. (Zie voor een berekening van de invloed van de temperatuur op de evenwichtsconcentratie: http://www.clepair.net/oceaanCO2-2.html). Dus de uit de metingen afgeleide gemiddelde evenwichtsconcentratie van 287 over de laatste 60 jaar past daar aardig in.
- W.J. Witteman: The absorption of thermal emitted infrared diation by CO2. http://www.clepair.net/witteman-CO2+IR.pdf
-



0 reacties :
Een reactie posten